エクソソームによる診断・治療の可能性
2023/06/26
細胞外小胞の一種であるエクソソームは、細胞間の情報伝達をになう物質としてその役割からがんをはじめとする疾患の診断・治療への応用が期待されています。Plug and Play Japanのアクセラレータープログラムや大手企業側からの新規事業探索においても、エクソソームに関連したニーズが高まっています。この記事ではヘルスケアやバイオテクノロジーにご関心のある方を対象に、エクソソームを活用したスタートアップや注目のラボをご紹介します。
Writer: Harunori Oiwa
Senior Ventures Associate
エクソソームとは何か?
エクソソームは、細胞から分泌される直径30 – 200 nm(ナノメートル)程度の顆粒状の脂質に分子膜小胞です。ヒト細胞の平均的なサイズである20 μm(マイクロメートル, 10 -6)より2 – 3桁小さいナノメートル(10 -9)レベルの非常に小さなサイズです。その表面には細胞膜由来の脂質・テトラスパニン類(CD9 ,CD63, CD81など)と呼ばれるタンパク質、内部にはDNA, メッセンジャーRNA, マイクロRNAなどの核酸や多様なタンパク質を含みます(Fig. 1)。
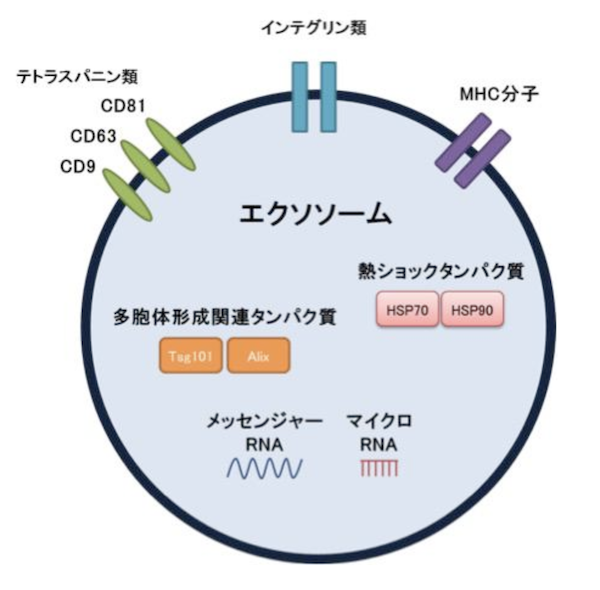 Fig. 1 エクソソームに共通して含まれるタンパク質など
Fig. 1 エクソソームに共通して含まれるタンパク質など
エクソソームは細胞外小胞(Extracellular Vesicles, EVs)の一種とされています。細胞外小胞にも様々な種類があることがわかってきているため厳密な定義は難しいですが、細胞外小胞のサブタイプとして、a. エクソソーム、b. マイクロベシクル、3. アポトーシス小体といったものがあります(Fig. 2)。
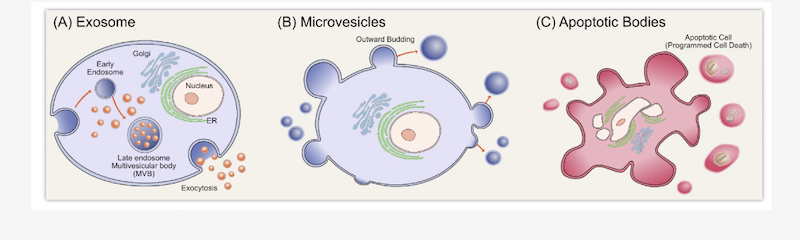 Fig. 2 細胞外小胞のサブタイプ:
Fig. 2 細胞外小胞のサブタイプ:
a. エクソソーム b. マイクロベシクル c. アポトーシス小体
細胞外小胞は1960年代にはじめて報告されましたが、当時、細胞内の要らなくなったタンパク質を細胞外に排出するものと考えられていました。
しかし、そこから60年近くの研究・技術進歩につれて、細胞外小胞の様々な可能性が明らかになってきました。特にそのサブタイプの1つであるエクソソームに関しては、細胞間のコミュニケーションに重要であることがわかってきました(Fig. 3)。
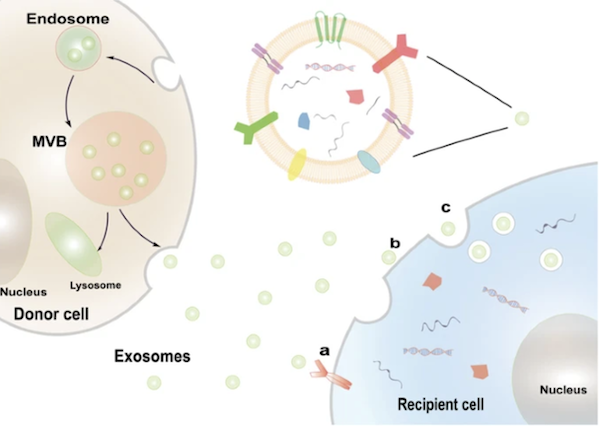 Fig. 3 エクソソームによる細胞間コミュニケーション
Fig. 3 エクソソームによる細胞間コミュニケーション
エクソソームは細胞と細胞の間や血液、尿、髄液といった体液中に存在し、循環する中でそれら細胞間の情報伝達の役割を果たしています。情報の出し手であるドナー細胞から受け手のレシピエント細胞に情報伝達するケースを考えてみましょう。
ドナー細胞から分泌されたエクソソームには、たくさんの情報がDNAやRNAといった核酸の形で含まれています。これらの情報をレシピエント細胞に伝えることでコミュニケーションを行っていると考えられています。
なぜエクソソームが注目されているのか?
細胞外小胞、特にエクソソームを対象とした論文数は非常に増加してきており(Fig. 4, 5)、またスタートアップとして研究が事業化されるケースも増えています。特に米国では既にEXIT(IPO or M&A)している企業も多く、今後この領域のさらなる発展に期待が寄せられています(Fig. 6)。
PubMedでの論文hit数:
- キーワード”Extracellular vesicles”:Total 43,119件
- キーワード”Exosome”:Total 30,936件(as of 12May2023)
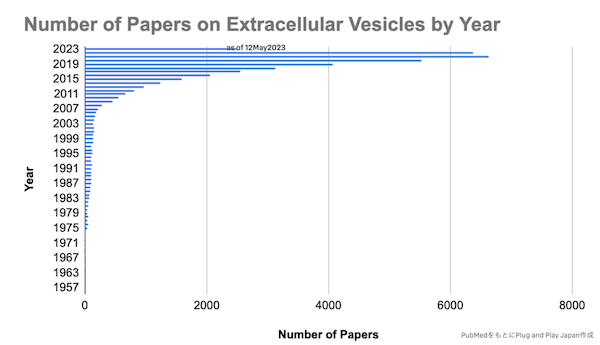 Fig. 4
Fig. 4
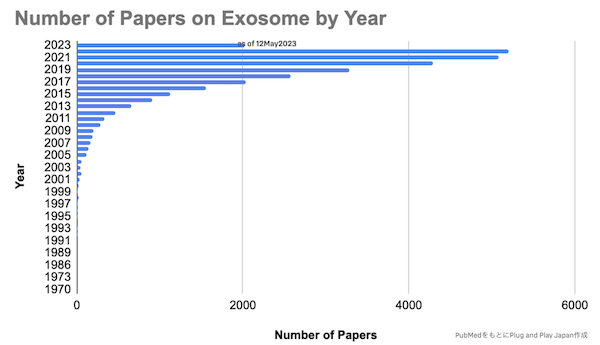 Fig. 5
Fig. 5
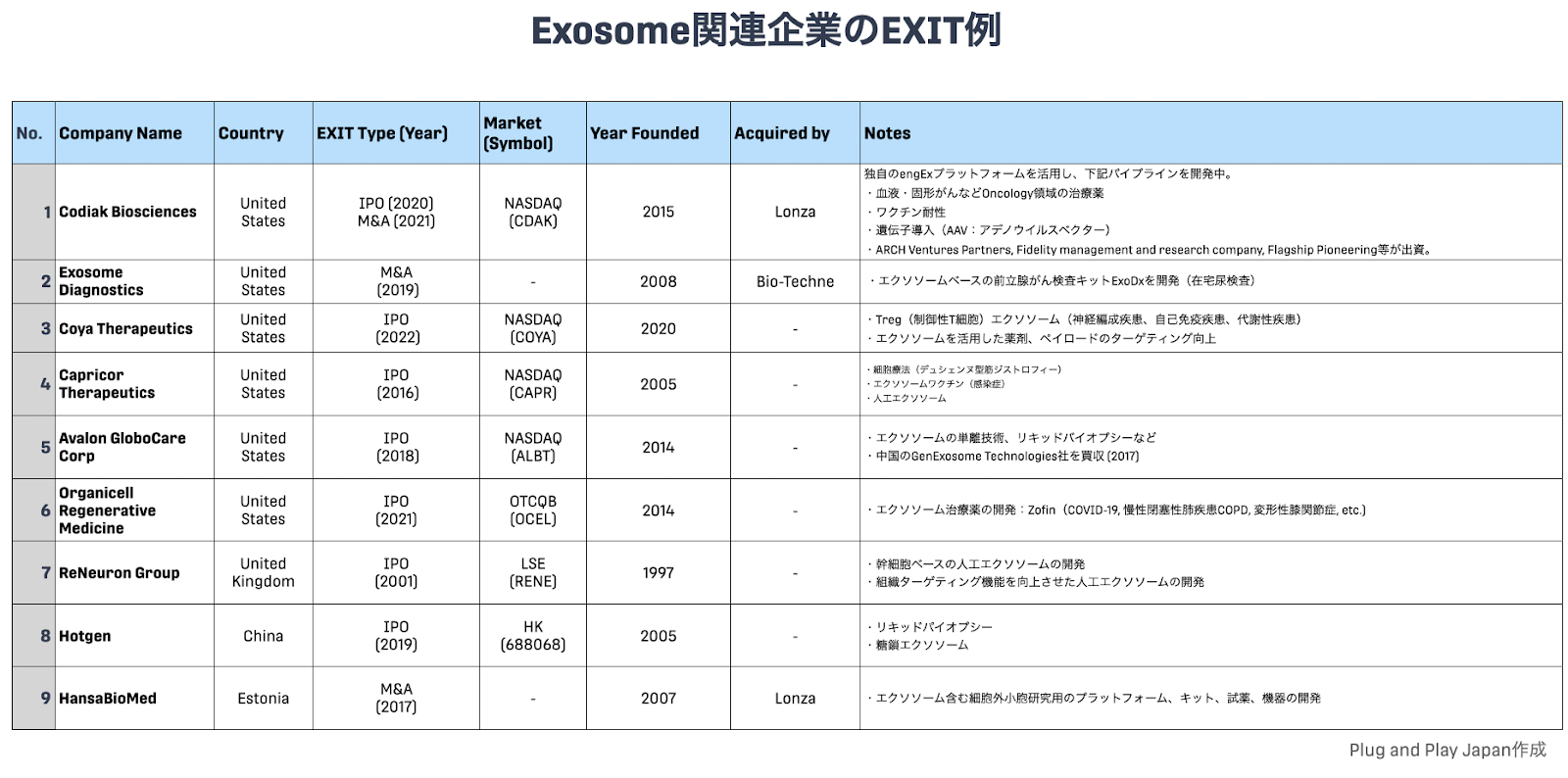 Fig. 6
Fig. 6
エクソソームの応用可能性
今後のさらなる研究により、新たな種類や定義、カテゴリ分け、機能の解明などが進んでいくことが予想されます。現在、例えば以下に対する取り組みが進められています。
1. リキッドバイオプシー(がん・感染症の早期診断)
がんの確定診断においては、生体組織を採取し、顕微鏡で観察する侵襲性の高い組織生検(バイオプシー)を行う必要があります。これを液体生検(リキッドバイオプシー)に置き換えることで以下のようなベネフィットが考えられます。
1. 膵臓がん、胆道がんなど検体採取が困難ながん種への適用
2. 侵襲性の低い体液採取(腕からの血液、尿)
3. がん細胞が一定まで増殖する前の早期発見
4. 検査所要時間の短縮
5. 繰り返し検査が可能になることによる身体への負担軽減
6. 検査費用の削減
7. 自宅検査キットでの検査取り組む研究機関や企業により、ターゲットとしている疾患や検査手法は異なります。血中に含まれるCTC、cfDNA、ctDNAを測定・解析するアプローチは代表的です。
-
※ 用語解説:
・CTC(Circulating Tumor Cells: 循環腫瘍細胞):原発腫瘍組織 or 転移腫瘍組織から血液中に遊離・循環する細胞。原発 or 転移腫瘍から遊離後血液中を循環し、他の臓器を侵襲することで転移性腫瘍を形成する。
・cfDNA(cell-free DNA: セルフリーDNA)/ctDNA(circulating tumor DNA: 血液循環腫瘍DNA):破壊された/アポトーシス(プログラム細胞死)した細胞に由来するDNA。cfDNAの中で特に、破壊されたがん細胞、アポトーシスしたがん細胞のことをctDNAと呼ぶ。ヒトの血中には体内の細胞から遊離したDNA断片が含まれるが、がん患者ではがん細胞に由来する特有の変異を持つことがわかっており、この微量な変化をゲノムシーケンシングで解析するといった手法が取られている。
-
- Startup Introduction #1
ctDNAを活用した例として、株式会社Liquid Mineを紹介します。同社はPlug and Play Japan Health Batch 3 Program採択および出資先のスタートアップであり、東京大学医科学研究所発の技術を事業化しています。白血病に対するリキッドバイオプシーを研究・開発しており、白血病の遺伝子構造変異を次世代ゲノムシーケンシング(NGS)によって解析することを特徴としています。詳細は以下の記事をご参照ください。
参照:Liquid Mine社への出資記事(2021年)
上記の代表例の他、血中/尿中に含まれる細胞外小胞(特にエクソソーム)を用いる取り組みも進んでいます。細胞外小胞は生体液中で比較的安定であり、細胞腫により異なるmiRNA(マイクロRNA)などが含まれているという特徴を持っており、細胞間コミュニケーションの役割を担うエクソソームに注目が集まっています。
これは、がんが特定の臓器に転移しやすい”臓器得意的転移”の性質を持つと考えられていることが関係しています。がん転移の成立には、”前転移ニッチ”と呼ばれる転移促進的な環境変化が起こるとされていますが、細胞間コミュニケーションの役割を担うエクソソームが転移先の臓器/細胞に影響を与えています(Fig. 7)。具体的にはITGαvβ5(インテグリンアルファv, ベータ5), ITGα6β4(インテグリンアルファ6, ベータ4), CEMIP(cell migration inducing hyaluronidase:ヒアルロン酸結合タンパク質の一種)が転移先の臓器・細胞に選択的に取り込まれることで、転移先はこちらです!というような郵便番号を伝えるような働きをしていることが報告されています。
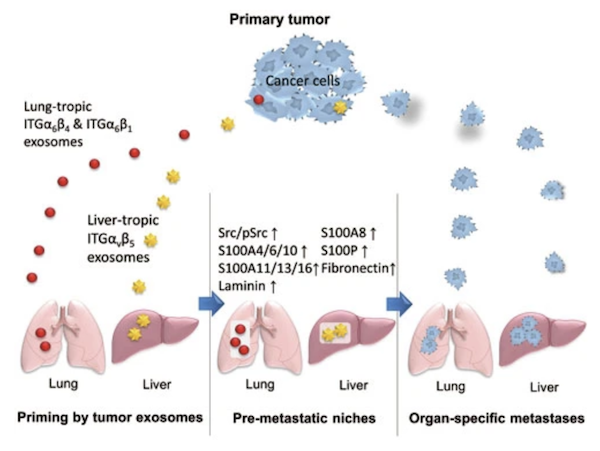 Fig. 7 がん進展時の転移前ニッチ形成におけるエクソソームの役割
Fig. 7 がん進展時の転移前ニッチ形成におけるエクソソームの役割
- Startup Introduction #2
エクソソームを活用したリキッドバイオプシーがん検査に取り組む代表的なスタートアップとして、国内ではCraif(クライフ)株式会社が挙げられます。同社はPlug and Play Japan Insurtech Batch 3(アクセラレータープログラム)の採択スタートアップであり、名古屋大学発の技術を活用し2018年に設立され、2022年にはSeries B Extension Roundでの調達を実施しています。
コアテクノロジーである、ナノ素材の開発技術により、マイクロ流体ナノワイヤデバイス、セルロースナノファイバーを用いることで、エクソソームを捕捉し、内包されているマイクロRNAなどの微量なバイオマーカーを検出、またAIを組み合わせることにより医療に応用しており、自宅で可能ながんリスク・スクリーニング検査サービス”miSignal®︎(マイシグナル)”を発売しています。同時に最大7種のがんリスク判定(大腸、肺、胃、乳、すい臓、食道、卵巣がん)が可能な点も特徴です。
- Startup Introduction #3
エクソソームを活用したリキッドバイオプシー・スタートアップとしてもう一社紹介します。Health Batch 7 Program採択で神戸大学発の株式会社TearExoは、検体として”涙”を用いたアプローチが特徴的です。独自技術でありエクソソームを高感度・迅速に検出する”TearExo法”を用いて前処理なく短時間で検査を行うことが可能です。現在開発を進めている乳がん検査に関しては、マンモグラフィ検診の身体的苦痛を軽減し、検査予約の手間や実施コスト削減することを通じて、受診率向上を目指しています。また、その他のがんに対する展開も検討しています。

Source: TearExo社website
株式会社TearExo 代表取締役 堀川 諒 氏

我々は極めてユニークなコア技術に基づいて、エクソソームセンシングチップの開発を行っています。誰もが、時間や場所を問わずに採取可能な涙を使って、自身の健康を管理し、疾病の発見遅れや罹患の恐怖から解放される世界を実現します。
2. Designer EVによる薬剤送達性の向上
合成生物学的手法の発展によって、細胞外小胞(EV)を人工的に改変し、新たな機能を搭載した”Designer EV”を用いた取り組みが進んでいます。例えば、通常の薬は脳の血液脳関門(Blood Brain Barrier: BBB)を通過できないことから、中枢神経に対する薬理効果が制限されることが課題としてありましたが、Designer EVを用いることでこの課題をクリアできるかもしれません。RNA, タンパク質といった機能性分子を搭載したDesigner EVをターゲットとする特定の細胞に送達することで、新薬の薬剤送達性(Drug Delivery System:DDS)の向上に寄与することが期待されます。
3. EV免疫療法・ワクチンの開発
免疫細胞由来の細胞外小胞(EV)の特性として、特定の免疫応答が誘導されることが
わかってきています。この特性を活用し、EVを直接ヒト体内に注射で投与する、または疾患に関与する抗原を含んだEVを体内で産生させるような新規の免疫療法・ワクチン開発が期待されています。
4. 新薬開発 エクソソーム治療薬(代謝性、遺伝性、免疫性疾患
前述のEXIT例で挙げたIPO/M&A企業の他、世界中で多くのスタートアップが新薬開発に取り組んでいます。例えばFig. 6で示したEXIT企業のようにがんなどの疾患領域に対するパイプラインが挙げられています。低分子化合物、抗体医薬、組み替えタンパク・ペプチド医薬、核酸医薬、遺伝子治療、細胞医薬といった創薬モダリティの多様化に寄与することが期待されます。
ラボ紹介:Xu Lab.
最後に事業化前段階ですが、関連する研究をおこなっているラボを紹介します。
紹介するのは、大阪公立大学大学院 工学研究科ナノ化学システム工学グループの許 研究室(Xu Lab.)です。筆者は2023年4月にラボを訪問し、許岩准教授にお話しを伺いました。
エクソソームを含むEVの分離方法は大きく3つにカテゴリ分けできます。
- サイズ:溶液中の分子サイズの違いを利用し成分を分離する手法。
e.g. サイズ排除クロマトグラフィー(Size Exclusion Chromatography: SEC)
- 密度:溶液中でEVを含んだサンプルを超遠心することで、各生体分子固有の密度を基にEVを分離する手法。
e.g. 密度勾配遠心分離法
- 親和性(アフィニティ):エクソソームの膜表面に発現し、エクソソームマーカーとして用いられることの多いテトラスパニン(CD9 , 63, 81, etc.)に対する抗体、EVの膜を構成する成分であるホスファチジルセリンに結合するタンパク質を用いた親和性によりEV精製を行う手法。または、EV膜との科学的な親和性や特殊な高分子添加剤を用いてEVを沈殿させる手法。
e.g. 磁気ビーズを用いた免疫沈降法、MagCapture法、高分子添加剤沈殿法
しかし、従来のエクソソーム単離解析技術開発には以下の課題があり、多くのLab.や医療現場に普及することが難しいのが現状です。
- 収量:実験には大量のサンプル(数十〜数百mL)が必要だが、単離プロセス後に得られるエクソソーム量はわずかである場合が多い。
- 解析の前処理:エクソソーム単離にはいくつかのアプローチがあるが、例えば超遠心分離法のプロセスが必要になる。しかし、このプロセスにはピペット操作や100,000g, 70 min以上の遠心時間が必要であり、また試料とするエクソソーム自体へのダメージが否定できない。
- 実験者の技量:検出・解析に用いる十分量・均質なエクソソームの回収には、高度な技術・豊富な経験を持つ専門者が必要。
これは、これまでの実験手法は細胞を対象とした分離・分析技術であり、記事冒頭で触れたようにエクソソームは細胞よりも2-3桁サイズが小さいことが影響しています。このような背景から、Xu Lab.では、エクソソームを濃縮して解析するための流体ナノデバイス“aifA”を開発しています。
 (参考)ナノ流体デバイス
(参考)ナノ流体デバイスSource: Xu Lab.提供
aifAにはバタフライ状のナノ流路およびナノウェルを埋め込んでおり、大量の単一ナノ粒子のアレイ化を可能にしているのが特徴です。また、従来の実験手法で課題として挙げられていた前処理は不要となり、実験者はエクソソームを含むサンプルをマイクロピペットでaifAに滴下するだけで1粒子精度のエクソソームトラップ・検出が可能となります。つまり、濃縮をせずに1個単位のエクソソームが検出・解析できるようになります。
許 岩(XU Yan) 大阪公立大学 大学院工学研究科 准教授

”現在、エクソソームの検出と解析に使用される技術のほとんどは、従来の細胞分析を対象とした生化学分析技術です。しかし、粒径が細胞よりも2桁小さいエクソソームの分析には適しているとは言えません。一方、ナノ流体デバイスのナノ流路は単一のエクソソームと同じサイズスケールを持っており、エクソソームの検出と解析に理想的な環境を提供できます。私たちはこれまでに、aifAという新しいナノ流体デバイスを使用して、エクソソームの簡便な1ステップ単離配列、迅速な検出、サイズ分画、高精度な解析を統合した革新的な技術を確立してきました。今後は、この技術をどこでも誰でも手軽に利用できるエクソソームの汎用的な技術に発展させていきます。”
エクソソームを活用したビジネスの可能性は非常に大きいものの、この分野における競合も増加してきており、スタートアップを成長させていくためには技術だけでなくビジネスモデルやEXITから逆算したプランニングが重要になります。
Plug and Play Japanは、日々多くのスタートアップ、医療機器・製薬・化学・材料系の大手企業を支援しています。ご関心のある方はお気軽にこちらからお問い合わせください。
Reference
- 地方独立行政法人東京都健康長寿医療センター
- Sangiliyandi Gurunathan Et al., “Review of the Isolation, Characterization, Biological Function, and Multifarious Therapeutic Approaches of Exosomes”, Cells 8(4), 307 (2019)
- Enli Yang. Et al., “Exosome-mediated metabolic reprogramming: the emerging role in tumor microenvironment remodeling and its influence on cancer progression”, Signal Transduction and Targeted Therapy 5, Article number: 242 (2020)
- Yang Liu Et al., “Organotropic metastasis: role of tumor exosomes”, Cell Research 26, 149–150 (2016)
- ct/cfDNA:日経バイオテク キーワード(2016)
- 実験医学 EVs 細胞外小胞の生物学(2021)
